IF29.5,RayBio抗体芯片结合多组学在铁死亡诱导癌症恶病质的机制及治疗靶点中的应用
文章题目:LCN2 secreted by tissue-infiltrating neutrophils induces the ferroptosis and wasting of adipose and muscle tissues in lung cancer cachexia
研究摘要
Abstrack
研究结果
Part.
1
肺癌恶病质消耗组织中LCN2水平升高
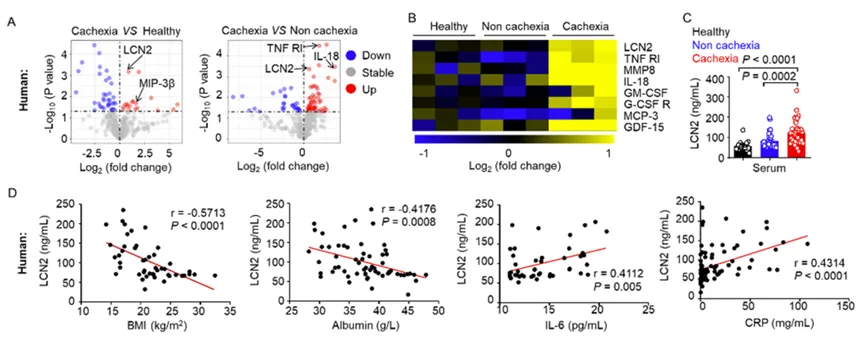
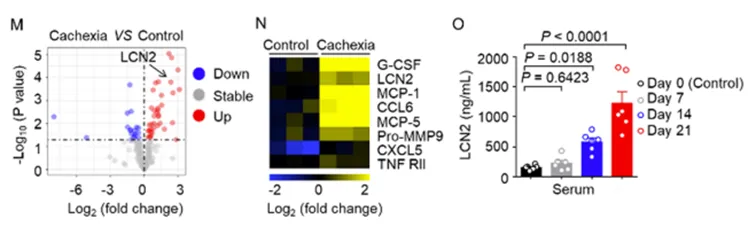
为确定人类肺癌恶病质的驱动因素,研究人员使用人RayBio 440个细胞因子抗体芯片(GSH-CAA-440)检测恶病质肺癌患者与非恶病质肺癌患者或健康对照者血清蛋白的表达变化,结果显示恶病质肺癌患者的LCN2水平异常高于非恶病质肺癌患者或健康人群(图1A, B)。此外,恶病质患者血清中的促炎细胞因子(如IL-6和CRP)水平也高于其他两组,从而表明恶病质与高度炎症环境相关。同时,研究人员使用RayBio小鼠200个因子定量抗体芯片(QAM-CAA-4000)对肺癌恶病质小鼠血清蛋白进行了分析,发现恶病质小鼠的LCN2水平明显高于对照组小鼠(图1M, N)。
Part.
2
肺癌恶病质的消耗组织中发生了铁死亡
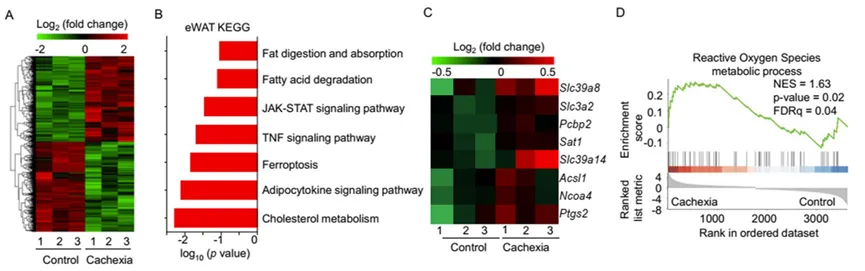
为了评估肺癌恶病质期间局部耗损组织微环境中发生的病理转变,研究人员在转录组水平上评估了LLC植入癌症恶病质小鼠耗损组织的变化。结果发现在恶病质小鼠和对照小鼠的eWAT产生的3624个DEGs中,1770个基因在恶病质小鼠中表达上调,1854个表达下调。KEGG富集分析结果显示,上调的差异基因在“脂肪酸降解”、“炎症”和“铁死亡”等途径中富集(图2A,B,C)。
Part.
3
外源性LCN2诱导小鼠铁死亡和组织损耗
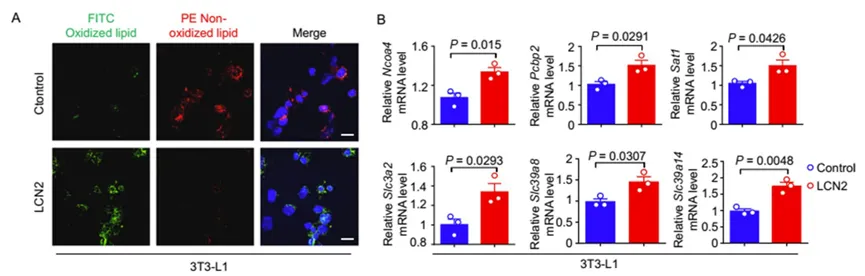
为研究LCN2水平对铁死亡的潜在影响,研究人员使用3T3-L1脂肪细胞进行了体外实验(图3A)。发现在3T3-L1细胞中添加重组小鼠Lcn2蛋白显著增加了细胞死亡程度、脂质过氧化及铁死亡相关基因(Ncoa4, Slc3a2, Slc39a8, Slc39a14, Pcbp2, Ptgs2, Sat1)的表达(图3B)。此外,使用铁凋亡抑制剂liproxstatin-1处理3T3-L1细胞,发现它减轻了Lcn2引发的MDA或脂质ROS水平的升高。表明LCN2可诱导培养脂肪细胞铁死亡。
Part.
4
LCN2敲除可减少肺癌恶病质中的铁死亡和组织损耗
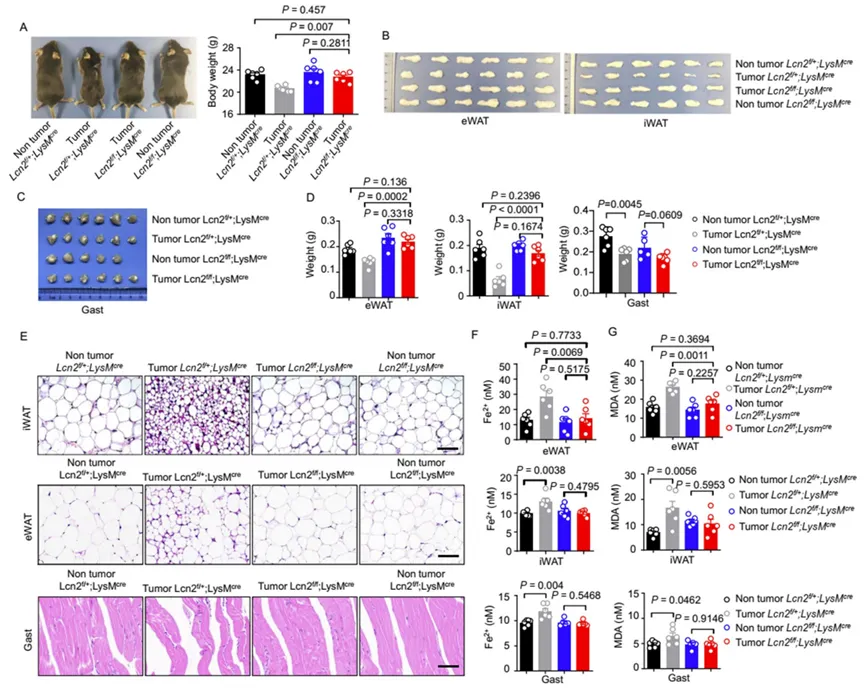
研究人员在对照组及髓细胞特异性LCN2敲除小鼠中诱导肺癌恶病质,以检测敲除LCN2的影响。发现肺癌恶病质的诱导导致对照组小鼠血清中LCN2蛋白表达增加,而LCN2敲除鼠血清中LCN2没有增加。此外,对照组小鼠表现出体重减轻(图6A),eWAT、iWAT和Gast明显减少(图6B-D)。铁死亡生化特征的检测结果显示,对照组小鼠的eWAT、iWAT和Gast中Fe2+和MDA浓度显著升高,而LCN敲除鼠没有升高(图6F、G)。
研究结论
Discussion
分子功能研究专题
要购买ELISA试剂盒的友友们,可擦亮眼睛吧!不要再上当受骗了
疾病研究专题







 RayBio资讯
RayBio资讯